文章最后更新时间:2024-08-12 19:50:23,由春晓健康网负责审核发布,若内容或图片失效,请留言反馈!
portant; word-wrap: break-word !important;">
portant; word-wrap: break-word !important;">2018年12月19日,美国食品和药物管理局(FDA)批准pembrolizumab(KEYTRUDA,派姆单抗)为患有复发性局部晚期或转移性Merkel细胞癌(MCC)的成人和儿童患者加速批准。
portant; word-wrap: break-word !important;">
portant; word-wrap: break-word !important;">该批准基于癌症免疫疗法试验网络协议9(CITN-09),也称为KEYNOTE-017(NCT02267603),这是一项多中心,非随机,开放标签试验,招募50名患有复发性局部晚期或转移性MCC的患者。未接受过先前全身治疗的晚期疾病。患者每3周接受2mg / kg的pembrolizumab。
portant; word-wrap: break-word !important;">
portant; word-wrap: break-word !important;">主要疗效结果指标是按RECIST 1.1盲法独立中心评价评估的总体反应率(ORR)和反应持续时间。ORR为56%(95%CI:41,70),完全反应率为24%。未达到中位响应持续时间。在28名有反应的患者中,96%的反应持续时间超过6个月,54%的反应持续时间超过12个月。
portant; word-wrap: break-word !important;">pembrolizumab最常见的不良反应在接受pembrolizumab作为单一药物的患者中至少有20%报告为疲劳,肌肉骨骼疼痛,食欲减退,瘙痒,腹泻,恶心,皮疹,发热,咳嗽,呼吸困难,便秘,疼痛,以及腹痛。
portant; word-wrap: break-word !important;">
portant; word-wrap: break-word !important;">对于成人,推荐的用于MCC的pembrolizumab剂量为200mg,每3周静脉输注30分钟; 对于年龄小于18岁的患者(儿科患者),每3周静脉输注30 mg / kg(最多200 mg)。
portant; word-wrap: break-word !important;">
portant; word-wrap: break-word !important;">什么是Merkel细胞癌?
portant; word-wrap: break-word !important;">
portant; word-wrap: break-word !important;">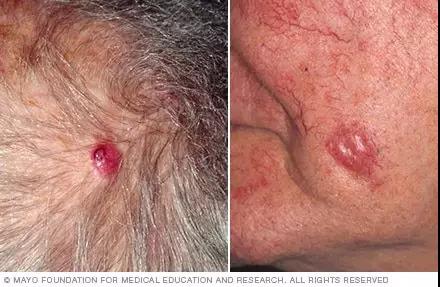
portant; word-wrap: break-word !important;">图片来自:梅奥诊所
portant; word-wrap: break-word !important;">Merkel细胞癌(Merkel cell carcinoma,默克尔细胞癌)是一种罕见的皮肤癌,通常表现为肉色或蓝红色结节,通常长在脸部,头部或颈部。Merkel细胞癌也称为皮肤神经内分泌癌。Merkel细胞癌最常见于老年人。长期日晒或免疫系统较弱可增加患Merkel细胞癌的风险。
portant; word-wrap: break-word !important;">
portant; word-wrap: break-word !important;">目前K药在中国获批用于黑色素瘤治疗,K药(Keytruda,可瑞达,派姆单抗)的详细使用说明及注意事项整理如下
portant; word-wrap: break-word !important;">
portant; word-wrap: break-word !important;">K药说明书
portant; word-wrap: break-word !important;">
portant; word-wrap: break-word !important;">【药物名称】
portant; word-wrap: break-word !important;">通用名:帕博利珠单抗注射液
portant; word-wrap: break-word !important;">商品名:可瑞达/Keytruda
portant; word-wrap: break-word !important;">英文名:Pembrolizumab Injection
portant; word-wrap: break-word !important;">
portant; word-wrap: break-word !important;">【成分】
portant; word-wrap: break-word !important;">活性成分:帕博利珠单抗
portant; word-wrap: break-word !important;">辅料:L-组氨酸,蔗糖,聚山梨酯80,注射用水
portant; word-wrap: break-word !important;">
portant; word-wrap: break-word !important;">【性状】
portant; word-wrap: break-word !important;">应为液体,基本不含可见颗粒
portant; word-wrap: break-word !important;">
portant; word-wrap: break-word !important;">【规格售价】
portant; word-wrap: break-word !important;">100mg/4ml:17918RMB。
portant; word-wrap: break-word !important;">
portant; word-wrap: break-word !important;">注:中国市场零售价为17918RMB/100mg;美国市场零售价为100mg/4ml:4800美金(33000RMB);香港市场零售价为100mg/4ml:30000港币(26200RMB)。(目前,中国只批准了100mg/4ml的规格,没有50mg的规格。中国K药售价仅约为美国的54%,香港的68%。)
portant; word-wrap: break-word !important;">
portant; word-wrap: break-word !important;">推荐剂量:2mg/kg剂量静脉输注30分钟以上,每3周给药一次,直至出现疾病进展或不可接受的毒性。以患者体重50Kg为例,一次需使用1支100mg/4ml,共17918元每3周,三个月共71672元。
portant; word-wrap: break-word !important;">
portant; word-wrap: break-word !important;">【适应症】
portant; word-wrap: break-word !important;">帕博利珠单抗适用于经一线治疗失败的不可切除或转移性黑色素瘤的治疗。
portant; word-wrap: break-word !important;">
portant; word-wrap: break-word !important;">该适应症在中国是基于一项单臂临床试验的客观缓解率结果给予的有条件批准。本适应症的完全批准将取决于正在计划开展中的确证性临床试验能否证实中国患者的长期临床获益。
portant; word-wrap: break-word !important;">
portant; word-wrap: break-word !important;">【贮藏条件】
portant; word-wrap: break-word !important;">将药瓶于2℃至8℃的冷藏环境下保存在原装包中,避光、避免冷冻、避免震荡。
portant; word-wrap: break-word !important;">
portant; word-wrap: break-word !important;">【包装】
portant; word-wrap: break-word !important;">1支/盒
portant; word-wrap: break-word !important;">
portant; word-wrap: break-word !important;">【有效期】
portant; word-wrap: break-word !important;">24个月
portant; word-wrap: break-word !important;">
portant; word-wrap: break-word !important;"> K药登陆中国精彩历程回顾
portant; word-wrap: break-word !important;">
portant; word-wrap: break-word !important;">2018年7月25日,K药上市;
portant; word-wrap: break-word !important;">2018年9月19日,K药开售。
portant; word-wrap: break-word !important;">2018年7月26日,默沙东公司宣布,其PD-1抑制剂药物Keytruda(Pembrolizumab)正式获得中国国家药品监督管理局审批,用于经一线治疗失败的不可切除或转移性黑色素瘤的治疗,成为继百时美施贵宝Opdivo之后第2个正式在中国上市的PD-1/PD-L1单抗类药物。
portant; word-wrap: break-word !important;">
portant; word-wrap: break-word !important;">Keytruda的中国上市时间比Opdivo晚了1个多月,但二者适应症不同。Opdivo用于二线治疗非小细胞肺癌,Keytruda则用于一线治疗后疾病发生进展的局部晚期或转移性黑色素瘤。尽管此次获批的适应症为经一线治疗失败的不可切除或转移性黑色素瘤。
portant; word-wrap: break-word !important;">
portant; word-wrap: break-word !important;">从全球范围获批适应症数量而言,K药是目前用于治疗晚期瘤种最广泛的免疫药物。它已在80多个国家获批使用,覆盖了11个瘤种的15个以上适应症,具体如下:
portant; word-wrap: break-word !important;">
portant; word-wrap: break-word !important;">

portant; word-wrap: break-word !important; overflow-wrap: break-word !important;">
添加医学顾问微信,加入抗癌交流群,获取更多关于癌症治疗的相关信息!







发表评论