文章最后更新时间:2024-08-12 20:24:20,由春晓健康网负责审核发布,若内容或图片失效,请留言反馈!
2024年4月23日FDA加速批准泛RAF激酶抑制剂Tovorafenib(托沃拉非尼、Ojemda)用于治疗复发或难治性儿童低级别胶质瘤
2024年4月23日,美国食品药品监督管理局(FDA)传来好消息,批准了Tovorafenib(托沃拉非尼、Ojemda)用于治疗6个月及以上的儿童低级别胶质瘤(LGG)患者,特别是那些肿瘤携带BRAF融合/重排或BRAF V600突变的患者。这项突破性的批准为患有这种罕见脑瘤的儿童带来了新的希望,为他们的治疗提供了新的选择。
获批依据:FIREFLY-1研究的积极结果
FDA的批准主要基于FIREFLY-1研究的结果,这是一项多中心、开放标签、单臂的II期临床试验,旨在评估Tovorafenib在治疗BRAF基因变异的复发/难治性儿童LGG中的疗效和安全性。
研究设计:
●纳入了76名携带BRAF激活变异的儿童LGG患者,他们之前至少接受过一线全身治疗;
●患者每周接受一次Tovorafenib治疗,剂量范围从290-476mg/m2,最大剂量为600mg;
●主要疗效终点为客观缓解率(ORR),通过盲法独立中心审查(BICR)确定。
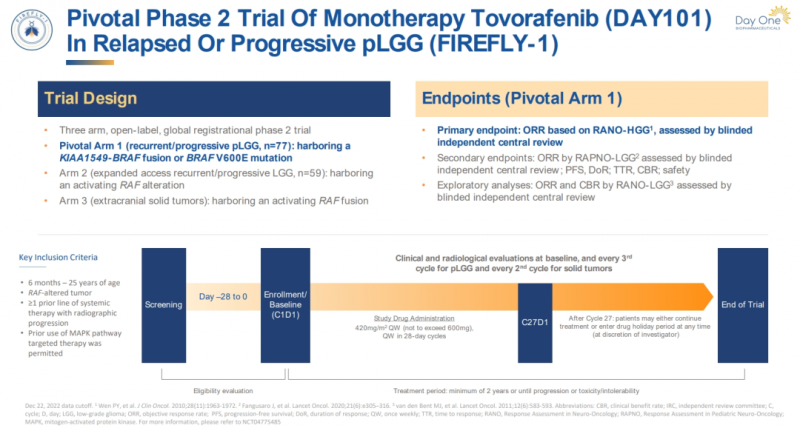
研究设计
研究结果:
●ORR达到51%,这意味着超过一半的患者肿瘤缩小或消失;

研究结果
●中位持续缓解时间(DoR)为13.8个月,这意味着许多患者的缓解效果持续了超过一年;
●安全性方面,Tovorafenib表现良好。 最常见的不良反应包括皮疹、发色改变、疲乏等,而3级或4级实验室检查异常包括磷酸盐降低、血红蛋白降低等。

安全性
Tovorafenib:新一代RAF激酶抑制剂
Tovorafenib是一种高度特异性的泛RAF激酶抑制剂,它能够抑制携带BRAF融合或BRAF V600突变的肿瘤的生长,并且具有大脑渗透性,这意味着它能够穿过血脑屏障,直接作用于脑肿瘤细胞。
与现有治疗手段的比较:
●与I型RAF抑制剂相比,Tovorafenib在作用机制上有所不同,避免了MAPK信号通路的异常激活,从而更有效地抑制肿瘤生长。
●与达拉非尼+曲美替尼联合疗法相比,Tovorafenib为携带BRAF融合的肿瘤患者提供了新的治疗选择。
儿童低级别胶质瘤:治疗挑战与希望
儿童低级别胶质瘤是儿童最常见的脑肿瘤,其治疗面临着许多挑战:
●肿瘤位置复杂: 一些肿瘤位于大脑的关键区域,难以完全切除。
●传统治疗手段有限: 化疗虽然有效,但副作用较大,且容易复发。
●缺乏针对BRAF融合的药物: 目前获批的BRAF抑制剂只对携带BRAF V600突变的肿瘤有效。
Tovorafenib的获批为儿童低级别胶质瘤的治疗带来了新的希望,它为携带BRAF融合的肿瘤患者提供了新的治疗选择,并且具有良好的疗效和安全性。
Tovorafenib的获批经历
●2023年3月16日,FDA批准达拉非尼联合曲美替尼用于治疗1岁及以上携带BRAF V600E突变的需系统治疗的低级别胶质瘤儿童患者。
●2022年6月22日,FDA批准达拉非尼联合曲美替尼用于治疗在先前治疗后进展且没有令人满意替代治疗方案的携带BRAF V600E 突变的6岁及以上不可切除或转移性成人和儿童实体瘤患者。
●2024年4月23日,FDA加速批准Tovorafenib用于治疗6个月及以上携带BRAF融合/重排或BRAF V600突变的复发或难治性儿童低级别胶质瘤(LGG)患者。
前景展望
Tovorafenib的获批标志着儿童脑瘤治疗领域的重要进展,为患有复发或难治性儿童低级别胶质瘤的患者提供了一种创新的治疗选择,未来,科学家们将继续努力,探索Tovorafenib的更多适应症,并将其与其他药物联合使用,以期进一步提高疗效,改善患者的预后。







发表评论