文章最后更新时间:2025-03-17 13:40:05,由春晓健康网负责审核发布,若内容或图片失效,请留言反馈!
本文概述了胃癌治疗的挑战与希望,重点介绍了FGFR2b靶点在胃癌治疗中的关键作用。文章指出,我国医疗机构联合开展了针对FGFR2b靶点的靶向药试验,旨在为晚期胃癌患者提供新的治疗选择。试验具有国际领先的治疗手段,参与者将获得专业医疗团队的关注。符合条件的患者可通过全球好药网咨询热线或在线报名参与试验,为胃癌治疗研究贡献力量。
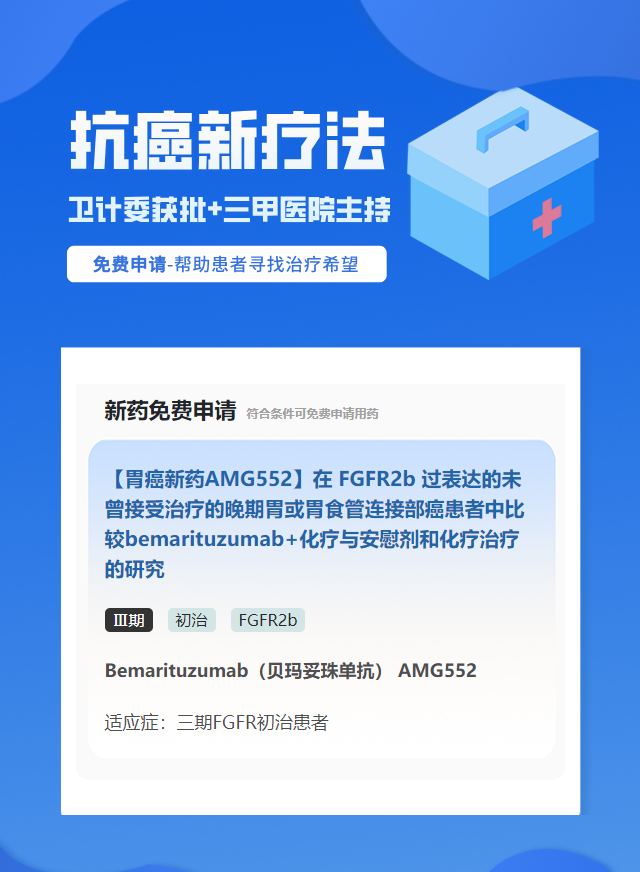
【潜江】胃癌FGFR2b靶点靶向药免费试验
项目名称:【胃癌新药AMG552】在 FGFR2b 过表达的未曾接受治疗的晚期胃或胃食管连接部癌患者中比较bemarituzumab+化疗与安慰剂和化疗治疗的研究
药品名称:Bemarituzumab(贝玛妥珠单抗) AMG552
基因分型:靶向药
突变基因:FGFR2b
临床期数:Ⅲ期
治疗线数:初治
适应症状:三期FGFR初治患者
项目优势:Bemarituzumab(贝玛妥珠单抗) 是全球首个(first-in-class)靶向FGFR2b的人源化单克隆抗体,主要通过两种方式发挥抗肿瘤作用:1.阻断肿瘤FGFR2b受体抑制其生长信号通路;2.增强NK细胞及巨噬细胞ADCC作用。

【潜江】胃癌FGFR2b靶点靶向药免费试验
一、胃癌的挑战与希望
胃癌是全球最常见的恶性肿瘤之一,严重威胁着人类的生命健康。长期以来,胃癌的治疗手段有限,患者预后较差。然而,随着分子生物学研究的深入,胃癌的精准治疗逐渐成为可能。
二、FGFR2b靶点与胃癌的关系
FGFR2b是纤维生长因子受体2b的简称,它在胃癌的发生、发展过程中起着关键作用。研究显示,FGFR2b基因的异常表达与胃癌的侵袭性、转移性及预后密切相关。因此,针对FGFR2b靶点的靶向治疗成为了胃癌研究的热点。
三、胃癌FGFR2b靶点靶向药试验
为了探索胃癌FGFR2b靶点靶向药物的有效性和安全性,我国多家医疗机构联合开展了“胃癌FGFR2b靶点靶向药试验”。该试验旨在为胃癌患者提供新的治疗选择,提高患者的生活质量和生存期。
四、试验内容与招募条件
试验内容:本次试验将评估胃癌FGFR2b靶点靶向药物在晚期胃癌患者中的疗效和安全性。试验药物为我国自主研发的创新药,具有高度选择性。
招募条件:
年龄18-75岁,男女不限;
经病理学检查确认为晚期胃癌患者;
肿瘤组织中FGFR2b基因呈阳性表达;
未曾接受过针对胃癌的靶向治疗;
自愿参加试验,并签署知情同意书。
五、参与试验的优势与意义
参与胃癌FGFR2b靶点靶向药试验,患者将有机会获得以下优势:
接受国际领先的治疗手段,有望提高生存期;
获得专业的医疗团队全程关注,保障治疗安全;
为胃癌治疗研究贡献力量,为更多患者带来希望。
六、如何参与试验
如果您或您的亲友符合招募条件,可通过以下方式参与胃癌FGFR2b靶点靶向药试验:
拨打全球好药网咨询热线:400-119-1082,了解更多试验信息;
前往试验医疗机构咨询,与专业医生沟通,了解试验详情;
登录全球好药网,在线提交报名信息,等待工作人员联系。
七、温馨提示
胃癌FGFR2b靶点靶向药试验为晚期胃癌患者带来了新的治疗希望。通过参与试验,患者有望获得更精准、更有效的治疗,提高生活质量。全球好药网作为专业的抗癌新药信息交流平台,将持续关注胃癌FGFR2b靶点靶向药试验的进展,为患者提供最新、最全面的抗癌资讯。欢迎广大患者和家属咨询热线:400-119-1082,了解更多相关信息。
入选标准
1.在开始任何研究特定的活动/程序前,受试者已提供知情同意。
2.年龄≥18 岁(或国内法定成人年龄,以年龄较大者为准)
3. 组织学记录的胃或胃食管连接部腺癌(不能进行根治治疗)。
• 原发肿瘤部位将按照美国癌症联合委员会 / 国际癌症控制联盟[AJCC/UICC]第 8 版进行分类。
4.不可切除的、局部晚期或转移性疾病(不能进行根治治疗)
5.基于存档(在签署预筛选知情同意书前 6 个月/180 天内获得)或新鲜活检肿瘤样本,通过在中心实验室进行的 IHC 检测测定 FGFR2b≥10% 2+/3+ TC
6.东部肿瘤协作组(ECOG)体能状态评分为 0 至 1。
7.适当的器官功能如下:
Ÿ 中性粒细胞绝对计数≥1.5x10^9 /L
Ÿ 血小板计数≥100x10^9 /L
Ÿ 在研究治疗首次给药前 7 天内未输注红细胞(RBC)情况下,血红蛋白≥9 g/dl
Ÿ 天门冬氨酸氨基转移酶和 ALT<3×正常值上限(ULN)(如果累及肝脏,则<5×ULN)。总胆红素<1.5×ULN(如果累及肝脏,则<2×ULN;Gilbert病受试者除外)
Ÿ 使用 Cockcroft 和 Gault 公式[(140-年龄)×体重(kg)/(72×肌酐mg/dL)](如果是女性,×0.85)计算或测量的肌酐清除率(CrCl)≥30mL/分钟
Ÿ 国际标准化比值或凝血酶原时间(PT)<1.5×ULN,但接受抗凝剂治疗的受试者除外,受试者必须在入组前 6 周使用稳定剂量的抗凝治疗
8.可测量的疾病或不可测量,但根据 RECIST v1.1 可评估的疾病。
9.受试者无 mFOLFOX6 化疗禁忌症
排除标准
1.未治疗或有症状的中枢神经系统(CNS)转移软脑膜疾病
2.心脏功能受损或具有临床意义的心脏疾病
3.2 级或以上外周感觉神经病
4.研究治疗首次给药前 14 天及以内存在需要全身治疗的活动性感染或任何未控制的感染
5.已知 HER2 阳性状态(阳性定义为 IHC 检测为 3+或 IHC 为 2+和原位杂交阳性[ISH])
6.已知存在人类免疫缺陷病毒(HIV)感染且 CD4+T 细胞(CD4+)计数<350个细胞/μL,丙型肝炎感染或乙型肝炎感染
7.间质性肺疾病病史
8.既往或当前存在需要长期使用眼用皮质类固醇的全身性疾病或眼科疾病
9.任何持续性眼科异常或急性(4 周内)或持续进展的症状的证据
10.研究治疗期间不愿意避免使用隐形眼镜
11.研究治疗首次给药前 28 天内的重大手术操作
12.最近 2 年内其他恶性肿瘤史,以下除外:
Ÿ 已根治的非黑色素瘤皮肤恶性肿瘤
Ÿ 原位宫颈癌
Ÿ 1 期经根治性治疗的子宫癌
Ÿ 根治的原位导管或小叶乳腺癌,目前没有接受任何全身治疗
Ÿ 以根治为目的接受手术治疗且假定已治愈的局限性前列腺癌
13.有角膜缺损、角膜溃疡、角膜炎、圆锥形角膜、角膜移植史或其他已知的可能会增加发生角膜溃疡风险的角膜异常的证据或近期(6 个月内)病史。近期(6 个月内)接受过角膜手术或眼科激光治疗
注:以上为部分入排标准







发表评论